.png)
MICOTOXINAS

Las micotoxinas son sustancias tóxicas creadas por ciertos tipos de hongos, como Aspergillus, Penicillium y Fusarium, siendo liberadas como un "mecanismo de defensa" para evitar que otros hongos compitan con ellos en el mismo espacio.
A pesar de los esfuerzos de organizaciones como el Sistema Mundial de Vigilancia FAO/OMS/PNUMA -Programa de Vigilancia y Evaluación de la Contaminación de los Alimentos por Micotoxinas, los niveles micotoxinas en alimentos no han hecho más que aumentar, posicionándose como uno de los problemas de mayor controversia a nivel mundial y, aun así, permaneciendo como un problema invisible en países como México.
Las aflatoxinas (AFs) son toxinas producidas naturalmente por mohos que crecen en climas cálidos y húmedos, como Aspergillus flavus y Aspergillus parasiticus, contaminando diversos productos agrícolas en cualquier etapa de su cadena alimentaria y siendo difícil de eliminar por su estabilidad y resistencia a altas temperaturas.
Las Aflatoxinas son consideradas las micotoxinas más peligrosas en cuanto a la seguridad alimentaria, al estar presentes en muchos productos destinados al consumo y estando clasificadas por la Agencia Internacional para la Investigación del Cáncer (IARC) como carcinógenas en humanos (Grupo 1).
No tienen olor, color ni sabor, y composición se basa en una estructura química compleja formada por tres partes principales: Una base de cumarina, un doble anillo de furano y un anillo de pentanona con cinco carbonos (en variedades B) o un anillo de lactona con seis carbonos (en variedades G).
Como otras micotoxinas, las Aflatoxinas tienen subclasificaciones:
Aflatoxinas B
Por la fluorescencia azul que emiten bajo luz ultravioleta, dividiéndose a su vez en tipo 1 y 2.
Aflatoxinas B1
Estructura química de la Aflatoxina B1.

Aflatoxinas B2
Estructura química de la Aflatoxina B2.

Aflatoxinas G
Por la fluorescencia que emiten bajo luz ultravioleta, dividiéndose a su vez en tipo 1 y 2.
Aflatoxinas G1
Estructura química de la Aflatoxina G1.

Aflatoxinas G2
Estructura química de la Aflatoxina G2.

Aflatoxinas M
Derivadas del metabolismo hepático de Aflatoxinas B y eliminadas en leche de humanos y animales. Se dividen en tipo 1 y 2.
Aflatoxinas M1
Estructura química de la Aflatoxina M1.

Aflatoxinas M2
Estructura química de la Aflatoxina M2.

Aflatoxinas Q1
Similar a las Aflatoxinas M, derivan del metabolismo hepático de Aflatoxinas B1.

Biosíntesis
La biosíntesis de Aflatoxinas se lleva a cabo mediante la vía metabólica secundaria de los policétidos, que utiliza productos de metabolismo primarios, como acetil CoA y malonil CoA, para por medio de reacciones enzimáticas, sintetizar Aflatoxinas.
Mecanismo
AFB1-8,9-Epóxido
Este metabolito activo se une a macromoléculas celulares como el ADN, provocando una expresión inmune no controlada, ya que la célula infectada será reconocida como un antígeno
AFB-N7-Guanina
Este metabolito activo se une al ADN y provoca lesiones en su estructura cambiando las bases nitrogenadas de Guanina-Timina.

Efectos a la salud
La aflatoxina tiene la capacidad de translocar y generar daño al ADN. Puede cambiar el orden de bases nitrogenadas de ADN, por lo que se consideran genotóxica y los cambios en el ADN cambian las características celulares, por ello se considera mutagénica.
Así mismo, el metabolismo de la aflatoxina ocurre por vía hepática, generando metabolitos tóxicos para el hígado, estos metabolitos a la vez son altamente cancerígenos.
Las Ocratoxinas (OTs) son toxinas producidas principalmente por Aspergillus ochraceus y Penicillium verrucosum. al igual que las Aflatoxinas, se benefician de en climas cálidos y húmedos, contaminando productos agrícolas como los cereales a lo largo de la cadena alimentaria. Son consideradas las segundas micotoxinas más peligrosas en cuanto a la seguridad alimentaria, siendo difíciles de eliminar por su estabilidad y resistencia a altas temperaturas.
Las Ocratoxinas también cuenta con subclasificaciones que consisten en:
Ocratoxina A (OTA)
Formada por un anillo de 3,4-dihidro metil isocumarina unido a una molécula de L-fenilalanina, tiene la capacidad de emitir fluorescencia bajo luz ultravioleta. Es la única Ocratoxina en ser clasificada como posible carcinógeno humano (Grupo 2B) por la IARC debido a un átomo de cloro en su estructura.

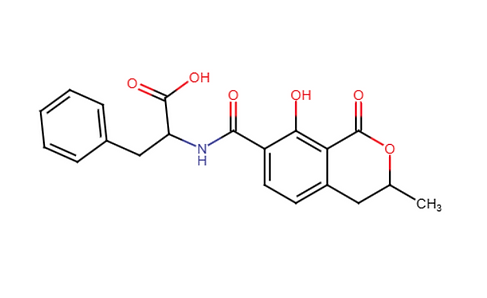
Ocratoxina B (OTB)
Estructura idéntica a la Ocratoxina A, a excepción del átomo de cloro, lo que le confiere una toxicidad significativamente menoR.
Ocratoxina α (OTα)
Es el producto de la hidrólisis de la Ocratoxina A, presentando una toxicidad menor a esta última.


Ocratoxina β (OTβ)
Es el producto de la hidrólisis de la Ocratoxina B, presentando una toxicidad menor a esta última.

Biosíntesis
La biosíntesis de Ocratoxina se lleva a cabo mediante la vía metabólica secundaria de los policétidos, que utiliza productos de metabolismo primarios como acetil CoA , malonil CoA y fenilalanina, para por medio de reacciones enzimáticas, sintetizar Ocratoxina.
Mecanismo
4(R)-hidroxi-OTA Hepatotóxica
Este metabolito activo se une fuertemente a las proteínas plasmáticas, lo que permite que su grupo halógeno actúe persistentemente dañando los hepatocitos.
4(R)-hidroxi-OTA Inmunosupresora
Este metabolito inhibe competitivamente la enzima fenilalanina-ARNt ligasa, bloqueando la síntesis de proteínas esenciales del sistema inmnológico.
4(R)-hidroxi-OTA Carcinogénica
Este metabolito activo se une a proteínas celulares y evita el proceso apoptótico normal de células tumorales, lo que induce carcinogénesis.
Produce ROS
Este metabolito activo es un agente altamente oxidante que daña a la célula y provoca su muerte.

Efectos a la salud
Esta toxina tiene en su estructura una molécula de cloro (Cl), lo que hace que sea altamente tóxica para las células del hígado. Su presencia, además, está altamente relacionada con la aparición de tumores por su capacidad de dañar las cadenas de ADN, derivando en carcinogenicidad.
Las Fumonisinas (Fs) son toxinas producidas principalmente por Fusarium verticillioides, Fusarium graminearum y Fusarium proliferatum. Al igual que otras micotoxinas, se dividen en diferentes subclasificaciones, estas consisten en A, B, C, P y H.
A pesar de sus diversos subtipos en donde se encuentran más de 15 tipos distintos de Fumonisinas, es en la variación B donde encontramos la más abundante y la más tóxica, representando alrededor del 70% de las toxinas totales encontradas en alimentos:
Fumonisina B1
Estructura química de la Fumonisina B1.


Biosíntesis
La biosíntesis de Fumonisima se lleva a cabo mediante dos vías metabólicas secundarias. Primero se necesita un policétido proveniente de la vía metabólica secundaria de los policétidos, una vez obtenido pasa a la segunda vía metabólica secundaria, la vía de los esfingolípidos. Donde por medio de reacciones enzimáticas y conjugaciones con ésteres se obtendrá como producto Fumonisima.
Mecanismo
FB-1 Carcinogénica
Este metabolito activo inhibe enzimas que estimulan la presencia de moléculas promitóticas y proapotóticas, lo que favorece la aparición de carcinoma.
FB-1 Mutagénica
Este metabolito activo provoca daño oxidativo en las estructuras de ADN, induciendo aberraciones en el cromosoma.

Efectos a la salud
La exposición a fumonisima está relacionado con el desarrollo de cáncer de esófago principalmente, pero también estimula la aparición de carcinoma en otros lugares del cuerpo. Después de metabolizar la fumonisima consumida, esta provoca daño en las estructuras de ADN, induciendo mutaciones genéticas.
La Zearalenona (ZEA) es una toxina producida por hongos del género Fusarium, principalmente Fusarium graminearum y Fusarium culmorum. Al igual que las Aflatoxinas y Ocratoxinas, se benefician de climas cálidos y húmedos, contaminando productos agrícolas como los cereales a lo largo de la cadena alimentaria, y siendo difíciles de eliminar por su estabilidad y resistencia a altas temperaturas.
Esta toxina en particular, a pesar de ser menos común, se caracteriza por su capacidad de imitar al estrógeno y activar sus receptores, al tener una estructura similar a los estrógenos naturales, alterando de esta manera la comunicación endocrina.


Biosíntesis
La biosíntesis de Zearalenona se lleva a cabo mediante la vía metabólica secundaria de los policétidos, utilizando acetil CoA y malonil CoA, productos de vías metabólicas primarias que por medio de reacciones enzimáticas sintetizan Zearalenona.
Mecanismo
A-Zearalenol
Este metabolito activo compite con los estrógenos por lo sitios de unión, interrumpiendo procesos de transcripción de ARNm.
A-Zearalenol
Este metabolito activo compite con las enzimas que sintetizan esteroides, generando disrupción endocrina.

Efectos a la salud
Esta micotoxina, al ser consumida interrumpe el proceso de transcripción de ARN mensajero, lo que promueve la aparición de tumores carcinogénicos en distintas partes del cuerpo, desde tumores hepáticos hasta cáncer de mama.
Otro de sus mecanismos en alterar el sistema hormonal uniéndose y bloqueando receptores, lo que resulta en infertilidad y otras alteraciones endocrinas.
El Deoxinivalenol (DON), también conocido como vomitoxina, es una toxina producida por Fusarium graminearum y Fusarium culmorum. Similar a otros hongos, se beneficia de climas húmedos y con altas temperaturas, siendo una presencia persistente en alimentos por su estabilidad frente a temperaturas extremas.
Su estructura química se caracteriza por la presencia de un anillo epóxido, un compuesto orgánico conformado por un anillo de dos carbonos y un oxígeno. Esta estructura es responsable de su actividad tóxica al ser muy tensa y como consecuencia, muy reactiva.


Biosíntesis
La biosíntesis de Deoxinivalenol se lleva a cabo mediante la vía metabólica secundaria de los tricotecenos, utilizando productos de otras vías metabólicas primarias para con la ayuda de reacciones enzimáticas lograr la síntesis de Deoxinivalenol.
Mecanismo
DON sin metabolizar puede sobreregular la transcripción de ARNm para la síntesis de proteínas inmunitarias, lo que genera inmunosupresión. Además, bloquea sitios de acción de quinasas, enzimas encargadas de regular la apoptosis y diferenciación celular.

Efectos a la salud
El consumo de deoxinivalenol causa distintos daños al cuerpo, desde ser toxico para las células de casi todos los tejidos del cuerpo, causando muerte de grupos celulares en hígado, riñón, corazón, sistema digestivo, incluso en embarazo dañando al feto.
Deoxinivalenol también ha demostrado poder inhibir la síntesis de células del sistema inmunitario, de esta manera generando inmunosupresión.
La Patulina (PAT) es una toxina producida por hongos del género Penicillium, principalmente Penicillium expansum, Penicillium claviforme, Penicillium patulum y Penicillium vulpinum. Es una micotoxina altamente estable, soportando altas temperaturas.
Su principal característica tóxica es su presencia en un grupo de compuestos comúnmente conocidos como lactonas tóxicas, compuestos químicos que pertenecen a la clase de las lactonas; sin embargo, a pesar de ser estable en un medio ácido de hasta 3.5, este potencial tóxico se pierde al hidrolizarse si llega a encontrarse en un medio alcalino.

Biosíntesis
La biosíntesis de Patulina se lleva a cabo mediante la vía metabólica secundaria de los policétidos, utilizando acetil CoA y malonil CoA proveniente de otras vías metabólicas que por medio de reacciones enzimáticas lograr la síntesis de Patulina.
Mecanismo
Metabolito activo Embriotóxica
Este metabolito activo es capaz de atravesar la barrera placentaria, junto con su capacidad citotóxica lo vuelve embriotóxico.
Metabolito activo Inmunosupresor
Este metabolito activo inhibe la actividad de enzimas inmunológicas que contengan grupos sulfhidrilo en su estructura, además de reducir la secreción de citocinas.
Produce ROS
Este metabolito activo es un agente altamente oxidante que daña a la célula y provoca su muerte.

Efectos a la salud
La patulina es una sustancia altamente toxica al ser metabolizada, ya que crea agentes que provocan muerte celular en distintos órganos, desde células gastrointestinales, toxicidad hepática y renal, además de inmunosupresión al inhibir proteínas del sistema inmunológico. En embarazo, los metabolitos de patulina pueden atravesar la barrera placentaria, presentando peligrosidad para el feto.
Identificación
Una de las características más particulares de las micotoxinas reside en la dificultad para su identificación, necesitando de métodos sensibles para una detección confiable.
Aunque existe una variedad de métodos, las primeras elecciones constan mayormente de métodos analíticos:
TLC
Método de separación cualitativo en donde la muestra se distribuye entre dos fases, una estacionaria y otra móvil, permitiendo que cada componente de la muestra se desplace a una distancia diferente dependiendo de factores fisicoquímicos.
HPLC
Método de separación cualitativo y cuantitativo en donde la muestra se distribuye entre dos fases, una estacionaria y otra móvil, permitiendo que los componentes de la muestra se separen en base a sus tiempos de retención
CG
Método de separación cualitativo y cuantitativo en donde la muestra se distribuye entre dos fases, una estacionaria (columna cromatográfica) y otra móvil (gas), permitiendo que los componentes de la muestra se separen en base a su volatilidad.
MS
Método de separación cualitativo y cuantitativo en donde las moléculas de la muestra son ionizadas, en otras palabras, se les “da” carga eléctrica, ya sea positiva o negativa; una vez ionizadas, estas moléculas son separadas de acuerdo con su masa y carga eléctrica, permitiendo determinar el peso molecular y la cantidad de cada compuesto
De igual manera, se han introducido métodos inmunoquímicos o inmunoensayos. La mayoría de estos métodos son muy sensibles, específicos y fáciles de operar por lo que su introducción ha revolucionado la manera en que se identifican las micotoxinas:
RIA
Columnas de inmunoafinidad
RIA
Técnica basada en una reacción antígeno-anticuerpo, se utiliza una muestra marcada con un radioisótopo (una forma inestable de un elemento que libera radiación al volverse estable) y una muestra no marcada, ambas compitiendo para unirse a un anticuerpo especifico. La muestra marcada puede cuantificarse, siendo inversamente proporcional a la concentración de la muestra no marcada.
ELISA
Técnica basada en una reacción antígeno-anticuerpo, la muestra es “marcada” con una enzima, que permitirá identificar y cuantificar la muestra con un espectrofotómetro al producir un cambio de color al unirse a su objetivo.
Ensayos cualitativos rápidos
Técnica basada en una reacción antígeno-anticuerpo de carácter cualitativo al brindar resultados rápidos, son fáciles de usar y en ocasiones no requieren equipo ni personal entrenado. Son realizados en tarjetas de plástico, tiras reactivas, copas de plástico, entre otros.
Columnas de inmunoafinidad
Método para la preparación de las muestras antes de ensayos como Cromatografía de líquidos de alta resolución o Cromatografía de Gases. Utilizan proteínas artificiales que imitan a anticuerpos naturales que aislarán las micotoxinas de interés, limpiándolas para reducir interferencias de otros componentes durante los análisis posteriores.
Eliminación
En los casos donde se confirme una contaminación, se necesitarán métodos adecuados para la eliminación de las micotoxinas. Según el tipo de sustancia utilizada, los métodos de descontaminación pueden dividirse en distintas categorías.
Métodos físicos
Presenta las ventajas de un costo bajo y su funcionamiento sencillo, sin embargo, los valores nutricionales o el sabor de los alimentos tratados con estos métodos pueden verse afectados.
Radiación
Incluye la radiación ultravioleta, radiación gamma, radiación de haz de electrones y la radiación de rayos X, reduciendo de manera segura los niveles de micotoxinas en los alimentos contaminados.
Adsorción física
Consiste en combinar material de adsorción con la micotoxina para formar un compuesto que no pueda ser absorbido por el organismo, pasando por el tracto gastrointestinal y eliminándose directamente a través de la excreción fecal.
Tratamiento térmico
Aunque considerado un método tradicional, a diferencia de otros métodos, su eficacia es considerablemente menor al considerar la resistencia a altas temperaturas que presentan la mayoría de las micotoxinas.
Aunque este método no puede eliminarlas completamente, pude disminuir la actividad si se considera la sensibilidad de algunas micotoxinas a niveles de pH específicos.
Otros métodos
Métodos químicos
Se basa en la destrucción del grupo tóxico en la estructura o en el cambio de solubilidad de la toxina mediante la hidrolización de uno de sus componentes, pueden utilizarse ácidos inorgánicos, ácidos orgánicos, compuestos alcalinos u oxidantes fuertes dependiendo de la micotoxina.
Métodos biológicos
Estos métodos se basan en el uso de otros microorganismos naturales como componentes principales, que inhibirán el crecimiento de los hongos productores de micotoxinas, fijando las micotoxinas que ya pudieran haberse producido y degradándolas a sus productos menos tóxicos.
Estos métodos tienen muchas ventajas, como bajos costos y efectos eficaces, siempre y cuando los microorganismos cumplan las siguientes características:
-
No ser patógenos.
-
Tener bajas demandas de crecimiento.
-
Ser capaces de degradar eficazmente la micotoxina.
-
No generar productos tóxicos.





















